近日,腾讯云深平台在药物 AI 算法研究领域取得新进展。
传统药物研发存在周期长、费用高和成功率低等特点,新药研发背后的分子设计需要成千上万次实验,准确性亟待提高,使用 AI 技术能极大改善这一现状。8 月下旬,腾讯 AI Lab 云深平台与成都先导药物开发股份有限公司(以下简称“成都先导”)合作,共同设计完成了业内首个经实验验证的骨架跃迁分子生成算法(GraphGMVAE),证明模型能高效并准确地寻找新的候选分子。
分子设计是新药研发的重要环节,骨架跃迁方法之于分子研究,就好比用乐高积木建房子,改造建筑部件或结构,造出更多样化的分子“建筑”。一般来说,分子设计中常用的传统骨架跃迁方法需要合成几十个、甚至上百个分子,才能找不到活性不错的分子,这一过程需要花费大量人力物力。该算法最少只设计合成了 7 个分子,即可达到相同的效果。
该研究结果发表于最新一期美国化学学会杂志 ACS Omega 上,为药物化学专家设计分子时提供更多启发,降本增效。

(图 1. 该项成果发表于行业知名期刊 ACS Omega 上)
骨架跃迁的意义
骨架跃迁是一种发现结构新颖化合物的策略。
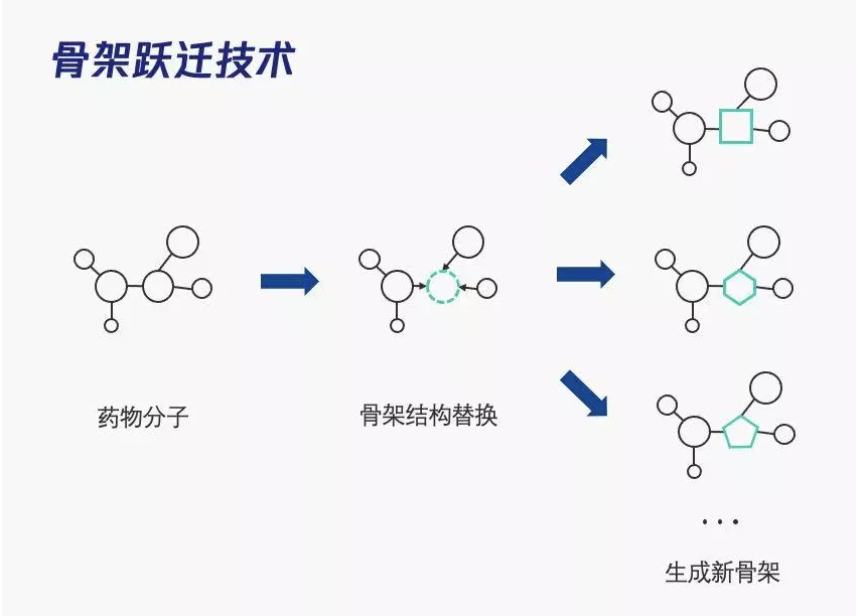
“骨架”概念广泛应用于药物化学和药物设计中,分析和比较活性化合物与衍生物的核心结构。骨架跃迁,是以已知的活性化合物为起点,通过改变分子的核心结构,获得新颖的化学结构。
找到结构新颖的化合物对新药研发具有重要意义,也是骨架跃迁的主要目的:(1)在已有的化合物分子结构上,产生新颖的化合物系列,增加药物研发成功率;(2)替换复杂天然产物的局部结构,产生更具选择性、更优活性的新颖分子;(3)通过改变分子的骨架,改善分子的药物代谢动力学性质。
传统骨架跃迁算法需要基于现有骨架库设计新分子。受限于骨架库大小,新分子在活性和多样性方面表现不足,而不断更新骨架库的过程也耗时耗力。近年来,AI 技术在分子生成领域取得进展,在探索更多更广的化学分子与骨架空间方面展示了更多潜力。
该算法在骨架提取方面结合了人工规则,更接近人类化学家的角色,不依赖于现有骨架库的大小规模。在一定程度上,AI 在分子生成领域能够探索更多分子空间。算法学到更符合化学定义的骨架,然后生成更多新颖的化学骨架。
此外,算法采用高斯混合分布来区分骨架和侧链部分,满足了骨架变化而侧链保持不变的要求。应用在新药研发的先导化合物优化阶段,GraphGMVAE 算法将有望提升小分子设计效率,从而减少人力以及时间成本。
腾讯 AI Lab 致力于 AI+医疗探索
腾讯 AI Lab 是腾讯企业级人工智能实验室,于 2017 年开始“AI+医疗”探索,不断拓展和深化研究与应用,涵盖影像筛查、病理诊断、药物研发多个领域。
团队已有多篇论文入选 MICCAI、RSNA,CVPR,AAAI 等顶级学术会议,并深度参与及主导多项应用落地,2020 年 11 月,腾讯自研的提升蛋白质结构预测精度的新方法曾登上 Nature 子刊。与合作伙伴合作研发中国首款获批进入临床应用的智能显微镜,发布 AI 驱动的药物研发平台“云深”,与钟南山团队联合发布新冠危重症预测模型等。在产业方面,腾讯与安必平、迈瑞等厂家进行了深入合作,推进 AI 在显微领域等广泛应用。
成都先导药物开发股份有限公司是一家从事新药研发的生物技术公司,总部位于中国成都,在英国剑桥、美国休斯顿设有子公司,并于 2020 年 4 月在上海证券交易所科创板挂牌上市(股票名称:成都先导,股票代码:688222.SH)。
成都先导并购了坐落于英国剑桥的 Vernalis 公司,该公司是 FBDD/SBDD 技术的领先者。成都先导为小分子及核酸新药发现与优化建立了一个国际领先的,以 DNA 编码化合物库的设计、合成和筛选(DEL),以及基于分子片段和三维结构信息的药物设计(FBDD/SBDD)为核心的技术平台。目前,公司基于数千种不同的骨架结构,已经完成超过万亿种结构全新、具有多样性和类药性的 DNA 编码化合物的合成,并且已有多个案例证实了其针对已知生物靶点和新兴生物靶点筛选苗头化合物的能力及有效性。
未来,该算法将应用于腾讯 AI Lab“云深”平台助力新药研发,结合平台 ADMET 预测工具优化先导化合物,使新生成的分子既保持生物活性,还能满足特定的药代动力学性质。同时 GraphGMVAE 还将尝试用于复杂天然产物的结构改造,寻找化学上更易合成、生物活性和性质更优的苗头化合物。
参考文献
1. Yu, Y. et al. A Novel Scalarized Scaffold Hopping Algorithm with Graph-Based Variational Autoencoder for Discovery of JAK1 Inhibitors. ACS Omega (2021) doi:10.1021/acsomega.1c03613.





